 |
 |
| 中西猛夫(薬学グループ代表)
金沢大学医薬保健研究域・薬学系 准教授 金沢市角間町 角間キャンパス 電話:076-234-4421,4479 E-mail:tamai@p.kanazawa-u.ac.jp 研究項目:体内物流制御分子の機能特性評価系の作製生体膜トランスポーターは、グルコースやアミノ酸のような生理的栄養物質を細胞内へ取り込んだり、毒性のある天然物や生体異物、代謝産物を細胞外へ排出したりすることによって、生命維持に欠かせない細胞内外の物質交換を厳密に制御している。近年、これらのトランスポーターが薬物の吸収、分布、排泄などの体内動態に影響を及ぼすことが明らかにされて以来、薬物を認識し輸送する薬物トランスポーターが薬効や副作用の発現の決定因子として位置づけられるようになってきた。また、悪性腫瘍や炎症などの病巣組織での薬物トランスポーターの発現変動が、病巣組織への薬物の移行性を左右したり、診断マーカーとして臨床的に重要な意義を持つ事例が見つかってきた。例えば、肝臓で代謝された薬物はABCC2とよばれる薬物トランスポーターにより速やかに胆管腔へ排泄されて、解毒が完了する。しかし、薬物によるMRP2の輸送阻害は、この排泄過程を阻害し、体内薬物濃度の上昇を引き起こす。我々は、ABCC2の蛍光基質の胆管腔内移行性を測定し、ABCC2輸送活性のリアルタイム可視化によるABCC2を介した薬物間相互作用の評価手法の開発に取り組んできた(図1)。 肝ABCC2は一例であり、その他にも医薬品等の消化管吸収過程、肺組織内移行、腎動態、腫瘍組織移行など体内物流の分子機構の解明とその可視化による新しい生理機構や病気の診断・治療の提唱に関する研究を推進している。 このように私たちは、本プロジェクトにおいて体内物流を制御する分子としてトランスポーターに焦点を絞り、薬効や副作用に関わるトランスポーター分子の機能的可視化に取り組み、薬物の細胞内動態を明らかにする評価系の作製を行う。その成果である体内物流制御分子の機能的可視化は、病態や治療のバイオマーカーの発見、医薬品候補化合物の薬効・副作用迅速スクリーニング、患者個別の病態に応じた薬物療法の促進など、医療・薬物療法と健康増進に技術革新をもたらすものと期待できる。 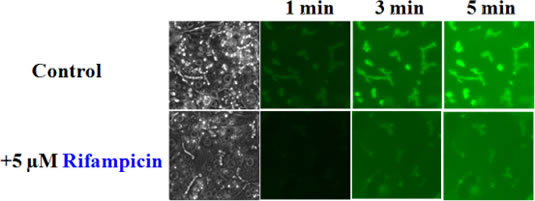
図1 MRP2の介した薬物相互作用評価系 - ラットの遊離肝細胞をサンドイッチカルチャーとよばれる特殊な培養法により、細胞間隙に胆管腔様の空間を形成させ、蛍光基質が胆管腔へ運ばれる様子の時間変化を可視化したもの(上、Control)。MRP2の基質となる薬物であるRifampicinを加えると、胆管腔への蛍光基質の移行は有意に減少することがわかり、MRP2とRifampicinの相互作用を可視的に評価することができた。 管理 構成員 |
| ページ最上部へ HOMEへ戻る |
| (C) Japan Society of Disaster Nursing |
